¿Qué es la Validación de Sistemas Informáticos?
La validación de sistemas informáticos es un proceso documentado que demuestra que un sistema cumple con sus especificaciones y requisitos operacionales, garantizando que los datos procesados sean precisos, confiables y seguros.
Este proceso es esencial en entornos regulados, donde un fallo del sistema podría afectar la calidad del producto, la seguridad del paciente o la integridad de los datos financieros.
Importancia de la Validación
«Si no está registrado, es solo un rumor«
Esta declaración subraya la importancia crucial de la validación. Cuando un proceso, sistema o los datos pasan por el proceso de validación adecuado, siendo registrados y aprobados oficialmente, se adquiere confiabilidad y el estado ‘validado’.
La buena noticia es que las regulaciones en todo el mundo están armonizadas, por lo que las reglas son similares en organismos reguladores como FDA, EMA y OMS.
Podemos destacar cuatro características que muestran la importancia de la validación:
- Cumplimiento regulatorio: Organismos como la FDA (EE.UU.), EMA (Europa) y ANMAT (Argentina) exigen la validación de sistemas en industrias reguladas.
- Reducción de riesgos: Minimiza errores que podrían afectar la calidad de productos o servicios.
- Integridad de datos: Garantiza que la información generada o almacenada sea exacta y consistente.
- Eficiencia operacional: Evita reprocesos y costosas correcciones por fallos del sistema.

¿Necesito validar todos los sistemas en una industria regulada?
¡La respuesta es, no! No todos los sistemas requieren validación, solo aquellos que son relevantes para las variables GMP (buenas prácticas de manufactura) que impactan en la calidad del producto y la integridad de los datos.
Por ejemplo, en un sitio de investigación y desarrollo o de fabricación, es probable que haya varios sistemas GMP relevantes debido a su conexión directa con el producto.
Por otro lado, si su empresa opera con distribución, simplemente se deberán validar los sistemas aplicables. Algunos ejemplos son WMS (Warehouse Management System), QMS (Quality Management System) y sistemas de monitoreo de temperatura, así como hojas de cálculo (si aplicable).
Normativas y Estándares Clave
Los sistemas validados de la industria farmacéutica utilizan estos estándares:
- FDA 21 CFR Part 11: Regula los registros electrónicos y firmas digitales en la industria farmacéutica.
- GxP (GMP, GLP, GCP): Buenas Prácticas que aplican a sistemas en laboratorios, manufactura y ensayos clínicos.
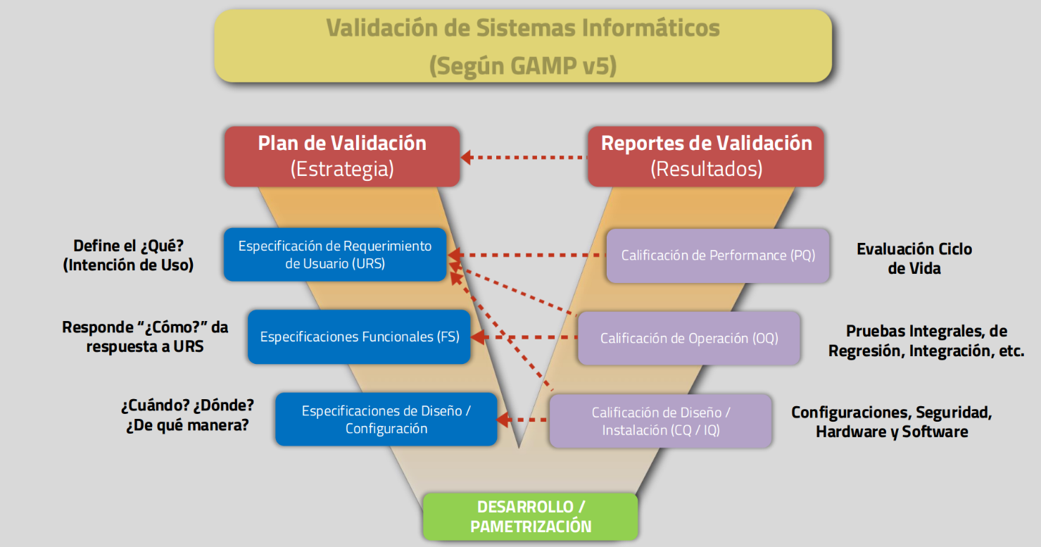
Etapas del Proceso de Validación
El enfoque V-Model (Modelo en V) es ampliamente utilizado en la validación de sistemas informáticos:
- Plan de Validación (VP): Define el alcance, responsabilidades y metodología.
- Especificación de Requisitos (URS): Documenta las necesidades del usuario.
- Especificación Funcional (FS): Detalla cómo el sistema cumplirá con los URS.
- Especificación de Diseño (DS): Describe la arquitectura técnica.
- Qualificación de Instalación (IQ): Verifica que el sistema esté instalado correctamente.
- Qualificación Operacional (OQ): Prueba las funciones del sistema.
- Qualificación de Desempeño (PQ): Confirma que el sistema funciona en condiciones reales.
- Informe de Validación (VR): Resume los resultados y aprueba el sistema para su uso.
Desafíos en la Validación de Sistemas
- Actualizaciones de software: Los cambios requieren revalidación parcial o completa.
- Sistemas legacy: Validar sistemas antiguos sin documentación adecuada.
- Cloud y SaaS: La validación de sistemas en la nube exige controles adicionales de seguridad y acceso.
Conclusión
La validación de sistemas informáticos no es un requisito burocrático, sino una inversión en calidad y seguridad. Las empresas que implementan procesos de validación robustos no solo cumplen con las regulaciones, sino que también mejoran su eficiencia y reducen riesgos operativos.
En un mundo cada vez más digitalizado, la validación seguirá siendo un pilar fundamental para garantizar la confiabilidad de los sistemas críticos.